JANSSEN компаниясының зерттеулері мен әзірлемелері
көптеген ғылыми жетістіктерге қол жеткіздік.

Біз денсаулық сақтау саласында 60 жылдан бері жұмыс істеп келеміз. Біз зерттеу жүргізу арқылы пациенттердің өмірін жақсартамыз. Біз ең ауыр дерттердің өзінде де тиімді инновациялық дәрі-дәрмектер мен емдеу тұжырымдамаларын әзірлейміз. Алайда жаңа дәрі-дәрмек ойлап табылғаннан бастап, пациент препаратты қолдана бастағанға дейін біраз уақыт өтеді.
Клиникаға дейінгі зерттеулеріміздің бір бөлігі ретінде біз перспективалық субстанция таңдалғаннан бастап дайын препаратқа дейінгі жолды жүріп өтеміз. Дүние жүзіндегі инновациялық орталықтар бізге ең заманауи технологиялар мен ең жаңа ғылыми деректерге қол жеткізуге мүмкіндік береді.
Клиникалық кезеңде — адамдардың қатысуымен жүретін ғылыми зерттеулерде дәрілік препараттың тиімділігі мен қауіпсіздігіне баға беріледі.

Молекуладан дәрілік препаратқа дейін
Жаңа дәрілік препарат қалай жасалады? Жаңа дәрілік препаратты жасау үшін ғылыми зерттеулер, заманауи әзірлемелер және, процеске қатысатын құзыретті мамандар қажет екені сөзсіз. Жаңа дәріні жасаудың бүкіл процесі әдетте он жылдан астам уақытқа созылады, ал оның құны кемінде 1-2 миллиард долларды құрайды.
Жаңа дәрілік препарат қалай жасалады?
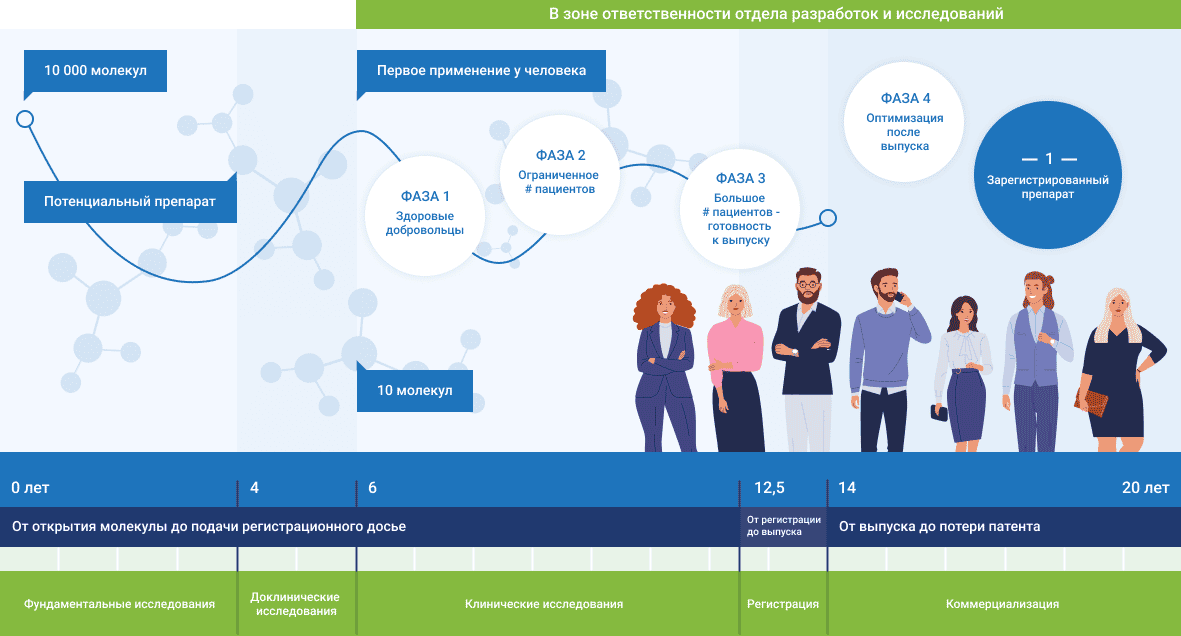
Жаңа препаратты жасаудың бүкіл процесі әдетте он жылдан астам уақытқа созылады, ал оның құны кемінде 1-2 миллиард АҚШ долларын құрайды.
Алдымен ауруды емдеу үшін немесе оның зардабын жеңілдету үшін қолдануға болатын затты табу керек. Бұл химиялық қосылыс, өсімдік немесе жануар тектес зат сығындысы, биотехнология мен генетикалық түрлендірілген жасушаларды қолдану арқылы алынған биопрепарат болуы мүмкін.
Негізінде тиімді және қауіпсіз дәрілік препаратты жасауға болатын заттар іріктеудің, әзірлеудің және сынаудың ұзақ жолынан өтеді. Бастапқы кезеңде іріктеліп алынған бірнеше мың перспективалық субстанциялардың көпшілігі "жолдан шығып қалады", ал соңында нарыққа дәрілік препарат түрінде енетін бір ғана зат қалады.
Әсер ететін затты іздеу
Аурулар ағзаның табиғи процестері өзгергенде немесе қызметін дұрыс орындай алмағанда пайда болады. Препаратты әзірлеу кезінде алдымен молекулалық деңгейді әбден түсініп алған жөн. Сонда патологиялық процесс "нысанаға" алынып, түзету енгізуге болады. "Нысана" ретінде ағзадан шамадан тыс немесе жеткіліксіз көлемде өндірілетін молекуланы немесе патологиялық құрылымы бар молекуланы таңдауға болады.
Жаңа дәрілік препараттарды жасау үшін перспективалық заттарды іздеу процесінде "нысана" молекулалармен байланысатын және олардың қызметіне әсер ететін субстанцияларды іріктеу және жасау үшін жасушалық дақылдарды — зертханалық жағдайда және виртуалды түрде сынау жүргізіледі. Сынақтарға дәрігерлер, химиктер, биологтар және ақпараттық технологиялар мамандары жұмыс істейді.
Клиникаға дейінгі зерттеулер
Перспективалық әсер ететін кандидат зат зерттеудің толық циклынан өтеді. Алғашқы сынақтар пробиркада және жасуша дақылдарында (in vitro) жүргізіледі. Мүмкіндігінше, Janssen компаниясы зертханалық жануарларға зерттеу жүргізуден бас тартады және оның орнына жасуша дақылдарымен немесе одан да ұсақ бірліктермен, яғни жасуша ішіндегі құрылымдармен жұмыс істейді. Дегенмен препараттың кейбір қасиеттерін тек тірі ағзаға (in vivo) сынап көруге болады, осылайша in vitro сынақтан сәтті өт�кен әсер ететін заттар жануарларға да сыналуы тиіс.
Фармакокинетика және фармакодинамика саласындағы мамандар әсер ететін заттың әсері мен ағзаның реакциясын бағалайды. Тиімділігімен бірге заттың жануардың ағзасына қалай сіңетіні, қалай таралатыны, заттың ағзада ыдырауы және одан зат қалай шығарылатыны да зерттеледі. Мұқият ойластырылған сынау тәртібі мен талдау әдістері жануарларға жүргізілген зерттеу нәтижелерін адамға да байқап көруге мүмкіндік береді.
Токсикологиялық зерттеулерде әсер ететін заттың қауіпсіздігі тексеріледі. Фармацевтикалық субстанциялардың жүрек пен бүйрекке әсері зерттеліп, жаңа субстанциялардың ағзаға уытты әсері болмайтынына, репродуктивті қызметіне және ұрықтың дамуына зиян болмайтынына, онкологияның дамуына және геномдағы өзгерістерге себеп болмайтынына көз жеткізіледі.
Фармацевтикалық субстанция барлық клиникаға дейінгі зерттеулерден сәтті өткеннен кейін ғана адамдарға зерттеу жүргізуге кірісуге болады. Бұл жерде препараттың қалай енгізілетінін шешу керек: ауыз арқылы немесе инъекция түрінде. Сондай-ақ әлеуетті дәрілік препаратты өнеркәсіптік ауқымда өндіру мүмкіндігін тексеру қажет. Осыдан кейін ғана препаратты әзірлеудің клиникалық зерттеу кезеңі басталады.
Дәрілік препаратты нарыққа жіберу үшін препараттың тиімділігі мен қауіпсіздігін растау қажет. Бұл үшін клиникалық зерттеулер жүргізіледі. Клиникалық зерттеулердің төрт кезеңі бар, дәрілік препарат әдетте олардан біртіндеп өтеді.
Дәрілік препаратты нарыққа шығарғаннан кейінгі клиникалық зерттеулер

Клиникалық зерттеу дегеніміз не?
Клиникалық зерттеу – бұл эксперименттік дәрілік препаратты немесе емдеу әдісін мұқият жоспарланған ғылыми тұрғыдан бағалау.
Клиникалық зерттеулерді дәрігерлер мен зерттеушілер жүргізеді және төмендегідей маңызды медициналық сұрақтарға жауап беруге көмектеседі:
- Зерттелетін препарат қауіпсіз бе?
- Оның адам ағзасына қандай әсері болады?
- Ол белгілі бір аурулар мен жағдайларға қалай әсер етеді?
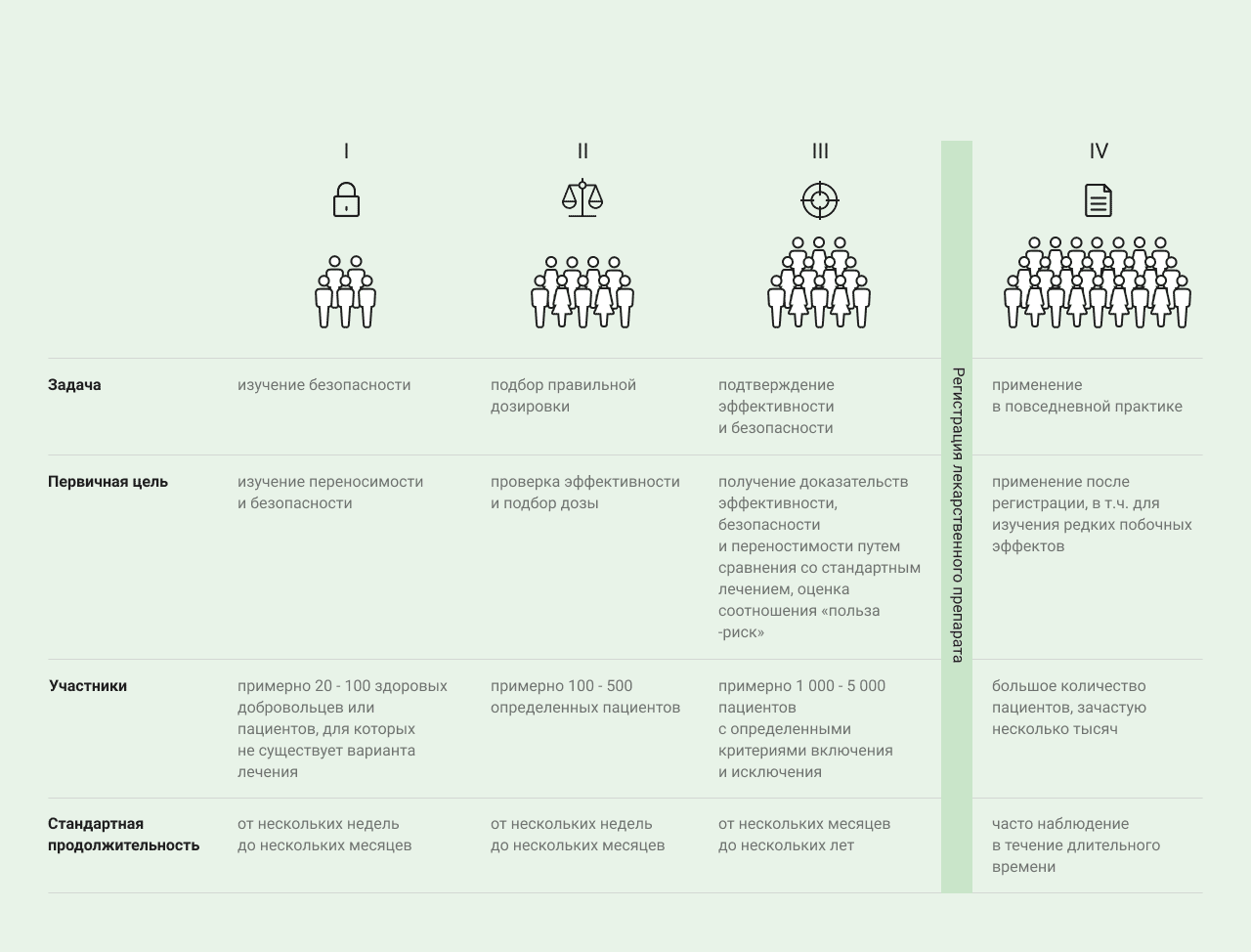
Клиникалық зерттеулердің төрт кезеңі бар:
Клиникалық зерттеулер не үшін қажет?

Препаратты нарыққа шығаруға (яғни оны сатуға) рұқсат алғаннан кейін препараттың әсерін егжей-тегжейлі зерттеу үшін қосымша зерттеулер қажет болуы мүмкін.

Біздің клиникалық зерттеулеріміз қатаң ғылыми, құқықтық және этикалық талаптарға сәйкес келеді. Зерттеуге қатысатын адамдардың қауіпсіздігі мен қорғалуын қамтамасыз ету — біздің басымдығымыз. Ресейде жүргізу үшін жоспарланған клиникалық зерттеулерді Ресей Федерациясының Денсаулық сақтау министрлігі және тәуелсіз этикалық комитеттер қарап, мақұлдайды.
Клиникалық зерттеу кезеңдері
| І кезеңде дәрілік препараттың адамдарға алғашқы сынақтары жүргізіледі | І кезеңде препараттың ағзаға үйлесуін, қауіпсіздігін және фармакокинетикасын, яғни әсер ететін заттың ағзадағы фармакокинетикалық әрекетін зерттеу үшін адамдарға алғашқы сынақтар жүргізіледі. Әдетте сынақтарға дені сау еріктілер қатысады. Препараттың қауіпсіздігі мен максималды сіңімді дозасы туралы алғашқы мәліметтер жиналады. Әдетте фармацевтикалық субстанцияның фармакокинетикалық сипаттамалары, яғни ағзаға таралуы және шығарылуы, сондай-ақ ағзаға түсетін тамақ өнімдерінің әсері және басқа белсенді заттармен өзара әрекеттесуі зерттеледі. Пайда мен тәуекел арақатынасы ойдағыдай бағаланғаннан кейін ІІ кезеңдегі клиникалық зерттеулер басталады. |
| ІІ кезеңде препараттың белгілі бір ауруы бар науқастарға әсері зерттеледі | ІІ кезеңде препараттың белгілі бір ауруы бар науқастарға әсері зерттеледі. Препараттың дозасын және ауруды емдеу тиімділігін зерттеуге пациенттердің қатаң талаптар бойынша іріктелген тобы қатысады. |
| ІІІ кезеңде зерттелетін субстанцияның тиімділігі мен қауіпсіздігін зерттеу жалғасады және пайда-тәуекел арақатынасы бағаланады | ІІ кезең ойдағыдай аяқталғаннан кейін ІІІ кезеңнің клиникалық зерттеулері басталады, онда зерттелетін субстанцияның тиімділігі мен қауіпсіздігін зерттеу жалғасады және пайда-тәуекел арақатынасы бағаланады. ІІІ кезеңге пациенттердің үлкен топтарының (1000-нан астам қатысушы) қатысуы сирек кездесетін жанама әсерлерді дәлірек бағалауға мүмкіндік береді. ІІІ кезең зерттеулерінің нәтижелері бойынша препаратты нарыққа шығару туралы шешім қабылданады. Кезең бақыланатын рандомизацияланған зерттеулер түрінде өтеді, оның аясында пациенттер топтарға бөлінеді. Пациенттердің бір тобы үшін зерттелетін субстанцияны енгізу тәсілі және ұсынылған емдік доза таңдалады. Салыстыру осы ауру кезінде стандартты ем алатын пациенттердің бақылау тобымен жүргізіледі. Пациенттер емдеу топтарына кездейсоқ тәсілмен бөлінеді, бұл рандомизация деп аталады. Дәрілік препаратты нарыққа шығаруға рұқсат алғаннан кейінгі клиникалық зерттеулер жалпы зерттеудің IV кезеңіне жатады. Қазір сатылып жатқан препаратты зерттеуді жалғастыру пациенттердің көпшілігінің оны қолдануы туралы мәліметтер алу үшін қажет. Осыған байланысты IV кезеңдегі зерттеулер бұрын тіркелген көрсеткіштер, дозасы және дәрілік нысан бойынша жүргізіледі. Көбінесе зерттеушілердің міндеті сирек кездесетін жанама әсерлерді анықтау немесе препараттың басқа препараттармен өзара әрекеттесуін зерттеу болып табылады. |

Зерттеу салалары
Janssen ауруларды өткен шақта қалдыратын болашақты жасағысы келеді. Бұл үшін біз күн сайын бүкіл әлем бойынша зерттеулер мен әзірлемелерге шамамен 20 миллион еуро инвестиция жұмсаймыз.

Бүгінгі таңда біз әзірлеген 18 препарат ДДҰ өмір үшін маңызы бар дәрілік препараттарының тізіміне енгізілді. Инновациялық препараттармен және терапиялық шешімдермен жұмыс кезінде «Янссен» компаниясы онкологияға, иммунологияға, инфекциялық ауруларға, психиатрияға, сондай-ақ өкпе гипертензиясын емдеуге ерекше назар аударады.
Онкология
Қуық асты безінің қатерлі ісігі, көптеген миелома, сүт безі қатерлі ісігі, онкологиялық аурулар кезіндегі анемия, аналық без обыры, Каслман ауруы, жіті миелоидты лейкоз, созылмалы лимфоцитарлық лейкоз, мантия жасушалы лимфома
Иммунология
Крон ауруы, псориаз, псориазды артрит, ревматоидты артрит
Инфекциялық аурулар
АИТВ, туберкулез, Эбола безгегі, гепатит, респираторлық синцитиалдық вирус, тұмау
Психиатрия
Шизофрения, зейін тапшылығы және гипербелсенділік синдромы (ЗТГС), эпилепсия, Альцгеймер ауруы, депрессия
Өкпенің артериялық гипертензиясы
Біздің клиникалық зерттеулеріміз басқа зерттеушілер үшін білім көзіне айналуы мүмкін. Сондықтан «Янссен» компаниясы ақпараттың ашықтығына ұмтылады: біз өз зерттеулеріміздің нәтижелерін ғылыми журналдарда жариялаймыз және ғылыми конференцияларда баяндама оқимыз. Біз сондай-ақ өз зерттеулеріміздің нәтижелерін келесі платформаларда тіркейміз:
- Халықаралық деректер қоры http://www.clinicaltrials.gov
- Қазіргі уақытта Еуропада жүргізіліп жатқан клиникалық зерттеулердің тізімі EudraCT еуропалық тізілімінде https://eudract.ema.europa.eu және Еуропаның дәрі-дәрмек агенттігінің (ЕМА) http://www.ema.europa.eu/ema/ сайтында берілді.
- Ресейде жүргізуге рұқсат етілген клиникалық зерттеулердің тізімі https://grls.rosminzdrav.ru/CIPermitionReg.aspx сайтында көрсетілді.
Интервенциялық емес (қадағаланатын) зерттеулер дегеніміз не және олар не үшін қажет?
Интервенциялық емес (қадағаланатын) зерттеуде дәрілік препарат қажетті рұқсаттарды алғаннан кейін препараттың нақты клиникалық тәжірибеде қолданылуы зерттеледі. Қатаң нұсқамаларға сәйкес және пациенттердің нақты анықталған тобының қатысуымен жүргізілетін интервенциялық клиникалық зерттеулермен салыстырғанда, қадағаланатын зерттеулерде дәрігер өз пациенттерін емдеудің стандартты әдістерін қолданады және емдеу процесін құжаттайды: мысалы, пациентке тағы қандай дәрі-дәрмектерді тағайындайтынын тіркейді және емдеу процесіндегі науқастың жағдайын бақылайды. Сондықтан бұл зерттеулер интервенциялық емес деп аталады —олар емдеуге араласуды көздемейді. Мұндай зерттеудің мақсаты — препарат туралы бұрын алынған мәліметтер оны қолданудың нақты клиникалық тәжірибесіне сай келетінін тексеру. Дәрілік препаратты тіркегеннен кейін де оның қауіпсіздігі, тиімділігі және ықтимал жанама әсерлері туралы ақпарат жинап отыру қажет.
Пациент қадағаланатын зерттеуге қатысушы ретінде қандай ем алады?
Қадағаланатын зерттеуге қатысу пациентке тікелей әсер етпейді: ол кез-келген жағдайда дәрігер тағайындаған емді алады. Қадағаланатын зерттеу аясында алынған дербес деректерді пациенттің келісімімен ғана пайдалануға болады. Зерттеуге қатыса отырып, пациент өзінің емделуі туралы деректерді құжаттауға және бағалауға рұқсат береді және осы келісімімен терапияны жақсартуға және аурудың даму себептерін түсінуге маңызды үлес қосады.
Қадағаланатын зерттеулер қандай ережелердің көмегімен реттеледі?
Қадағаланатын зерттеулерді жүргізу қатаң регламенттеледі. Қадағаланатын зерттеулер халықаралық сапа стандарттарына сәйкес жүргізіледі: түсіндіру сұхбатынан кейін пациенттің келісімін алумен қатар, қадағаланатын зерттеуді тәуелсіз этикалық комитеттер қарайды және бекітеді.
Клиникалық зерттеуге кімдер қатыса алады?
Әрбір клиникалық зерттеуге қатысушылар нақты белгілер (критерийлер) бойынша таңдалады.
Клиникалық зерттеуге қатыса алатын пациенттерді анықтайтын сипаттамалар зерттеуге қосу критерийлері деп аталады. Қандай пациенттердің зерттеуге қатыса алмайтынын сипаттайтын белгілер зерттеуге қоспау критерийлері деп аталады. Мұндай сипаттамаларға пациенттің жынысы, жасы, белгілі бір аурудың болуы, оның кезеңі мен ұзақтығы, алдыңғы емделудің ерекшеліктері, қатар жүретін аурулар және т.б. жатады.
Критерийлер қатысушыларды дұрыс таңдауға және олардың қауіпсіздігін қамтамасыз етуге көмектеседі. Критерийлер зерттеушілердің зерттелетін сұрақтарға жауап беруі үшін де қажет.
Зерттеу кезінде дәрігерлер қадағалауын жалғастыра бере ме?
Иә. Көптеген клиникалық зерттеулер пациенттің белгілі бір ауруға немесе жағдайға байланысты қысқа мерзімді қатысуын болжайды. Зерттеу аясында кеңейтілген немесе толық бастапқы медициналық көмек әрдайым көрсетіле бермейді.
Емдеуші дәрігер мен зерттеу тобының өзара әрекеттесуі басқа дәрі-дәрмектер немесе емдеу әдістері клиникалық зерттеу хаттамасына қайшы келмеуі үшін де қажет.
«Хабардарлық туралы келісім» дегеніміз не?
Егер сіз зерттеуге қатысуды ұйғарсаңыз, сізге "Хабардарлық туралы келісім нысаны" деп аталатын құжат беріледі. Бұл құжат клиникалық зерттеу туралы маңызды ақпаратты қамтиды және оған қатысуға келісіміңізді растайды. Хабардарлық туралы келісімнің мақсаты:
- клиникалық зерттеуге қатысу нені қамтитынын, соның ішінде ықтимал жанама әсерлер және зерттелетін дәрі-дәрмектермен немесе зерттеу рәсімдерімен байланысты басқа қауіптерді түсінетініңізге;
- зерттеуге қатысушы ретінде өз міндеттеріңізді түсінетініңізге;
- зерттеу туралы барлық сұрақтарыңызға жауап алғаныңызға;
- зерттеуге шынымен қатысқыңыз келетініне;
- кез-келген уақытта қатысудан бас тартып, зерттеуден шығуға болатынын білетініңізге көз жеткізу болып табылады.
Сіз бұл құжатты үйге апарып, тағы бір мұқият оқып шығып, шешім қабылдамас бұрын отбасыңызбен, достарыңызбен және емдеуші дәрігеріңізбен кеңесе аласыз.
Келісім нысанына қол қойғаннан кейін де сіз кез келген уақытта зерттеуге қатысудан бас тарта аласыз.
Егер сіз клиникалық сынаққа қатысуды шешсеңіз одан әрі не болады?
Қатысушылар хабардарлық туралы келісім нысанына қол қойғаннан кейін оларға скринингтік тексеруден өту ұсынылады. Бұл ретте қатысушы осы зерттеуге қатысуға жарамды екеніне көз жеткізу үшін сынақтар мен тексерулерден (хабардарлық туралы келісім құжатында сипатталған) өтеді. Осының бәрі расталғаннан кейін пациент зерттеуге қосыла алады.
Зерттеу барысында пациент зерттеуші дәрігерге үнемі барып тұрады, зерттеу емшараларынан (хабардарлық туралы келісім құжатында сипатталған) өтеді. Зерттеу барысында сіздің жағдайыңызды құрамында дәрігерлер, медбикелер және басқа да денсаулық сақтау мамандары бар зерттеу тобы мұқият бақылайды. Олар зерттеуге қатысушының денсаулығын тексереді, нұсқаулық береді және зерттеудің басынан аяғына дейін қадағалайды. Кейбір клиникалық зерттеулер ауруды әдеттегідей емдеу үшін қажет болғаннан гөрі көбірек тексерулер мен дәрігер тексерістерін қамтиды. Пациенттің клиникалық зерттеуге ойдағыдай қатысуының кепілі – зерттеу хаттамасының талаптарын қатаң сақтау және зерттеу тобымен жиі байланыста болу.
Зерттеу басталғаннан кейін қатысушы клиникалық зерттеуден шыға ала ма?
Клиникалық зерттеуге қосыла отырып, ерікті пациент кез келген уақытта және кез келген себеппен қатысуды тоқтатуға құқылы. Егер пациент қатысудан бас тартқысы келсе, ол зерттеу тобына хабар беруі тиіс, осылайша зерттеуде емдеуді қауіпсіз тоқтату қамтамасыз етіледі және тиісті медициналық қадағалау ұйымдастырылады.
Дәрігермен нені талқылау керек?
Клиникалық сынақтарға қатыспас бұрын дәрігермен бірге келесі сұрақтарды та�лқылағаныңыз жөн:
- Клиникалық зерттеудің нақты мақсаты қандай?
- Зерттеу қалай өтеді?
- Зерттеудің ақысын кім төлейді?
- Зерттеуге қатысу кезінде менің тарапымнан қандай шығындар болуы мүмкін?
- Шығындарды өтеу қарастырылған ба?
- Зерттеуге қатысушылар сақтандырылады ма?
- Зерттеу қанша уақытқа созылады?
- Зерттеуге қатысушы ретіндег�і менің міндеттерім қандай?
- Зерттеуден кейін ұзақ мерзімді медициналық бақылау қажет пе?
- Бұрынғы емдеу әдістерімен салыстырғанда зерттеуге қатысудың пайдасы мен қаупі қандай?
- Жаңа емдеу әдістерін қолдану тәжірибесі бар ма?
- Қандай жанама әсерлері болуы мүмкін?
- Зерттеуге қатысушыларды қолдауға кім жауапты?
- Төтенше жағдайда немесе сұрақтар туындаған кезде кімге жүгіне аламын?
- Қандай деректер жиналады, өңделеді жә�не сақталады?
- Клиникалық зерттеудің басында немесе барысында қандай шектеулер қолданылуы мүмкін (мысалы, жүктілікті жоспарлауға бола ма, алкоголь ішімдіктер ішуге бола ма)?
- Зерттеу уақытынан бұрын аяқталса, не болады?
- Зерттеуден кейін, қажет болған жағдайда, емдеу қалай жүреді?